Per quanto riguarda la forma degli orbitali essa varia da un orbitale all’altro. Essa dipende dal numero quantico secondario l, il volume dipende anche dal numero quantico n
Gli orbitali che possiedono lo stesso numero quantico l, hanno la stessa forma.
Vediamo nel particolare:
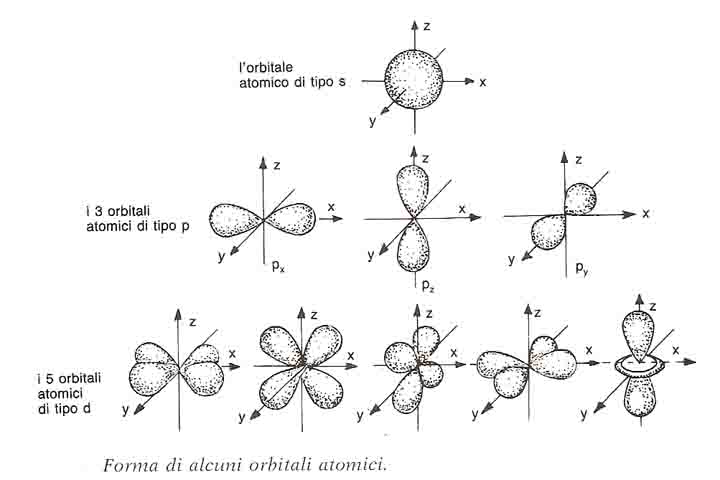
- gli orbitali con l=0 si dicono di tipo s . Per esempio l’orbitale s con n= 1 si chiama 1s, con n=2 si chiama 2s. Gli orbitali s hanno tutti la forma sferica, si differenziano però per dimensioni e per energia. Infatti, all’aumentare di n aumentano il raggio dell’orbitale e l’energia dell’elettrone.Per esempio la sfera dell’uranio dell’orbitale 1s ha un raggio 92 volte maggiore dell’orbitale 1s dell’idrogeno. Si descrive con un solo quadratino.
- gli orbitali con l=1 sono di tipo p. Esistono tre orbitali per l=1 detti orbitali p, più precisamente verranno descritti come
 .Tutti gli orbitali p hanno la forma di doppio lobo, il nucleo si trova nella congiunzione tra i due lobi .Per distinguerli è importante anteporre alla p il valore del numero quantico principale. I tre orbitali p con n=2 si chiameranno 2p; i tre orbitali p con lo stesso valore di n hanno uguale dimensioni ed energia, la stessa forma a due lobi ma orientamento diverso. Se il valore di n è diverso, gli orbitali p hanno la stessa forma, ma diverse dimensioni ed energia. Graficamente si rappresentano con tre quadratini.
.Tutti gli orbitali p hanno la forma di doppio lobo, il nucleo si trova nella congiunzione tra i due lobi .Per distinguerli è importante anteporre alla p il valore del numero quantico principale. I tre orbitali p con n=2 si chiameranno 2p; i tre orbitali p con lo stesso valore di n hanno uguale dimensioni ed energia, la stessa forma a due lobi ma orientamento diverso. Se il valore di n è diverso, gli orbitali p hanno la stessa forma, ma diverse dimensioni ed energia. Graficamente si rappresentano con tre quadratini. - gli orbitali con l=2 sono di tipo d. Esistono 5 orbitali di tipo d. Per distinguere i diversi orbitali con diverso valore di n, si premette il valore di n al simbolo d. Per esempio se n=3, l’orbitale si chiamerà 3d. Essi hanno la forma di quattro lobi che si incontrano nel nucleo. I cinque orbitali d si rappresentano con cinque quadratini;
- gli orbitali con l=3 sono di tipo f. Esistono 7 orbitali di tipo f. Anche per loro per distinguerli si premette il valore del numero quantico principale. I sette orbitali f si rappresentano graficamente con 7 quadratini.