Massa atomica e massa molecolare
Pesare un atomo non è possibile, non esiste ancora una bilancia che sia in grado di farlo. Quindi visto che non si può calcolare la massa assoluta di un atomo si ricorre alla massa relativa di esso. Cioè si calcola prendendo come riferimento un altro atomo.
Per misurare la loro massa oggi si usa lo spettrometro di massa. Il campione di riferimento per la determinazione della massa atomica è l’isotopo 12, cioè .
L’unità di massa atomica (u) corrisponde a un dodicesimo della massa atomica assoluta del carbonio 12 (). Quindi è il rapporto tra la massa assoluta dell’elemento e la dodicesima parte della massa assoluta dell’atomo di C
All’atomo di carbonio non viene data massa unitaria ma 12.
Sulla tavola periodica vine riportato per ogni elemento il valore della massa atomica , chiamato anche peso atomico.
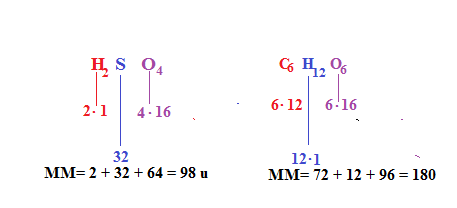
Se parliamo di una molecola la sua massa detta molecolare sarà il risultato delle somme delle singole masse atomiche degli elementi che compaiono nella formula della molecola.
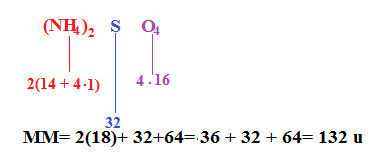
La formula di alcuni composti è scritta in questo modo: . L’indice numerico fuori dalla parentesi ci vuole dire che nel calcolare la massa molecolare il la MM di OH si dovrà moltiplicare per 2.
Quindi MM di = 24,31 + (16 + 2) •2 = 58,31 u.
Facciamo altri esempi del conteggio della massa molecolare di alcuni composti:
Consideriamo l’esempio in cui siano presenti le parentesi.