I numeri quantici e gli orbitali
La funzione d’onda ψ ci permette di definire i vari stati in cui si trova l’elettrone nell’atomo. Esso contiene tre numeri interi, chiamati numeri quantici n, l, m.
Un numero quantico quindi specifica il valore di una proprietà dell’elettrone e contribuisce a definire lo stato quantico dell’elettrone stesso.
A ciascuna terna di valori di n, l, e m corrisponde un particolare stato quantico dell’elettrone. Alla funzione d’onda elettronica che contiene tale terna di numeri si dà il nome di orbitale.
Il numero quantico principale n
Il numero quantico principale (n) definisce le dimensioni e l’energia dell’orbitale. Esso assume tutti i valori interi e positivi compresi tra 0 e 7.
n= 1, 2,3,4,5,6,7
All’aumentare del valore di n aumenta la distanza dal nucleo e quindi aumentano anche le dimensioni e l’energia dell’orbitale.
Ovviamente lo stato più basso di energia lo si ha quando n= 1.
Tutti gli orbitali che hanno lo stesso valore di n , appartengono allo stesso livello energetico.
Il numero di orbitali che ci sono per un dato valore di n è uguale a n². Per esempio se n=1 , appartiene un solo orbitale perchè 1²= 1; se n=2 , abbiamo 2²= 4 orbitali; se n= 3, abbiamo 3² = 9 orbitali ecc.
Il numero quantico secondario l
Il numero quantico secondario (l) è detto anche azimutale o angolare e ci da indicazione a riguardo della forma dell’orbitale e assume tutti i valori interi compresi tra 0 e n-1.
l= 0…n-1
Per esempio se n= 3 , avremo che l= 0,1,2.
Tutti gli orbitali con lo stesso valore di n ma diverso di l costituiscono un sottolivello. Quindi è l a definire il sottolivello a cui appartiene quel determinato orbitale. Il numero di sottolivelli presenti nei primi quattro livelli energetici sono:
| l | lettere sottolivelli |
| 0 | s |
| 1 | p |
| 2 | d |
| 3 | f |
Se per esempio l ha valore 1, il sottolivello è contraddistinto dalla lettera p; a tale lettera verrà anteposto il numero quantico principale, in modo da specificare il livello energetico a cui appartiene. Scriveremo 2p che ovviamente equivale alla coppia di numeri quantici n=2 ed l=1.
Il numero quantico magnetico m
Il numero quantico magnetico m, precisa l’orientazione dell’orbitale nello spazio rispetto ai tre assi ortogonali x,y e z. Il suo nome deriva dal fatto che esso determina le proprietà dell’atomo quando è sottoposto ad un campo magnetico esterno. Esso assume tutti i valori compresi tra -l e +l.
m= -l…o…+l.
Nel sottolivello l=0 avremo che m=0; se l=1 significa che m=-1,0,+1; se l= 2 avremo m=-2,-1,0,+1,+2.
Esso quindi definisce il numero di orbitali di ciascun sottolivello energetico.
Orbitali con lo stesso valore di n e valore di l , ma con diverso m , quindi con diversa orientazione si dicono degeneri.
Sono degeneri:
n=2 l=1 ,m=-1 n=2 l=1 m=0 n=2 l=1 m=1
Il numero quantico di spin 
Il numero quantico di spin descrive il moto di rotazione dell’elettrone intorno al proprio asse.
Esso può assumere solo due valori a seconda se la rotazione avvenga in senso orario o in senso antiorario.
 e
e 
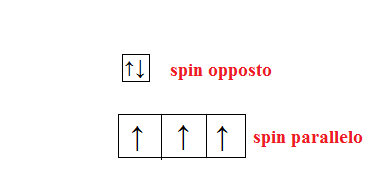
Per rappresentare lo spin si rappresenta l’elettrone con una freccia verso l’alto(↑) per verso il basso (↓)
Secondo il principio di esclusione di Pauli un orbitale può descrivere lo stato quantico di soli due elettroni e devono avere spin opposto.
Quando due elettroni si trovano nello stesso orbitale con diverso numero quantico di spin, si dice che hanno spin opposto e si rappresentano con due frecce opposte; se si trovano in due orbitali con lo stesso numero quantico di spin si dice che hanno spin parallelo.