I passaggi di stato avvengono quando le sostanze e i materiali per effetto della variazione di pressione o di temperatura da uno stato fisico all’altro. Quindi essi sono tutti quei fenomeni in cui la materia cambia il suo stato fisico.
Per modificare lo stato fisico di un corpo è necessario scaldarlo o raffreddarlo, variando la temperatura o la pressione che agisce su di esso.
Quindi ogni passaggio di stato avviene con assorbimento o liberazione di energia.
Possiamo distinguere i cambiamenti di stato che avvengono con assorbimento di energia e quelli con liberazione di energia.
I passaggi che avvengono con assorbimento di energia sono:
- solido-liquido (fusione)
- liquido- vapore (vaporizzazione che si distingue in evaporazione ed ebollizione )
- solido-vapore (sublimazione)
I passaggi che avvengono con liberazione di energia sono:
- liquido-solido (solidificazione)
- vapore-liquido (condensazione)
- vapore-solido (brinamento)
Se prendiamo ad esempio un cubetto di ghiaccio(solido) che è alla temperatura di 0°C e gli forniamo calore esso si trasforma in acqua (liquido) e quindi abbiamo avuto la fusione; se riscaldiamo ancora l’acqua essa arrivata alla temperatura di 100°C si trasforma in vapore e tale passaggio di stato si chiama evaporazione.
Ci sono alcune sostanze solide come la naftalina che con il riscaldamento si trasformano direttamente in vapore, questa è la sublimazione.
Invece se sottraiamo energia termica i passaggi di staro avvengono in senso inverso. Se un gas passa direttamente allo stato solido, esso si chiama brinamento.
Se prendiamo una sostanza pura come ad esempio l’acqua distillata questa avrà una propria curva di riscaldamento e di raffreddamento che varierà solo se in essa verrà disciolto dell’altro.
CURVA DI RISCALDAMENTO DI UNA SOSTANZA PURA
Prendiamo in considerazione l’acqua distillata e la raffreddiamo fino a -18°C. A questo punto riscaldiamo pian piano il ghiaccio e annotiamo le variazioni della temperatura in funzione del tempo. Otteniamo così la curva di riscaldamento.
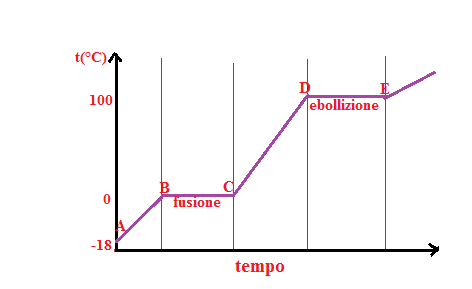
Analizzando il grafico notiamo che il ghiaccio da A→B riscaldandolo aumenta la propria temperatura fino a raggiungere i zero gradi centigradi centigradi che è la temperatura di fusione; il ghiaccio continua a fondere e tutto il calore che continuiamo a fornirci non farà aumentare la temperatura, infatti continuiamo a stare nel tratto B→C e cioè alla temperatura di 0°C. Ciò perchè tutto il calore fornito servirà per trasformare tutte le molecole di ghiaccio in liquido e quindi per vincere la forza di coesione esistente tra loro. Il tratto B→C viene detto sosta termica. Maggiore è la quantità di ghiaccio che deve fondere e più lunga sarà la sosta termica.
Continuami a riscaldare l’acqua, superata la sosta termica comincerà nuovamente ad aumentare la sua temperatura fino ad arrivare a 100°C. A questa temperatura ha inizio un nuovo passaggio di stato che si chiama ebollizione. Nel tratto D→C c’è quindi un’altra sosta termica per far sì che tutte le particelle di liquido si trasformassero in vapore.
La quantità di calore scambiato durante il passaggio di stato, quindi durante la sosta termica si chiama calore latente.
Il calore latente di fusione è la quantità di energia necessaria per fondere completamente 1 kg di sostanza pura, alla temperatura di fusione.
Il calore latente di vaporizzazione è la quantità di energia necessaria per vaporizzare completamente 1 kg di sostanza, alla temperatura di ebollizione.
Se consideriamo la curva di riscaldamento di un miscuglio notiamo che questo non ha soste termiche.
Per ogni sostanza pura è possibile disegnare una propria curva di riscaldamento o raffreddamento, quello che cambierà sarà una diverse temperatura per i vari passaggi di stato.
L’acqua abbiamo visto che bolle a 100°C ma se ci trovassimo in alta montagna poichè la pressione esterna si abbassa essa bollirebbe a circa 80°C. Invece, per esempio la pentola a pressione poiche aumenta la pressione e quindi aumenta la temperatura di ebollizione e ciò rende più veloce la cottura dei cibi.
Per quanto riguarda la curva di raffreddamento di una sostanza pura è la seguente:
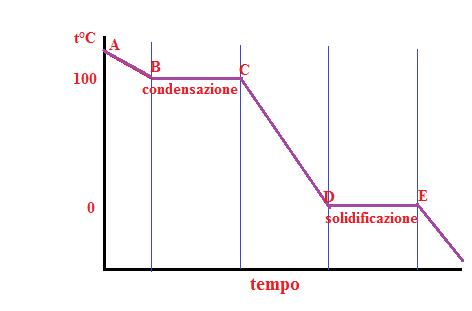
Tale curva funziona come quella di riscaldamento ma in modo inverso. Se raffreddiamo il vapore, la temperatura scenderà fino a 100° C, raggiungendo la temperatura di condensazione; tale passaggio di stato sarà finito quando tutto il vapore si sarà trasformato in liquido, quindi durante la sosta termica B→C. Trasformato tutto il vapore in liquido continuando a raffreddarlo la sua temperatura comincerà a calare fino a raggiungere gli 0°C e cioè la temperatura di solidificazione. Tutto il liquido si sarà trasformato in solido durante il tratto D→C, cioè la sosta termica.