Le proprietà chimiche e la maggiore o minore reattività di una molecola, spesso dipendono dalla disposizione nello spazio, quindi dalla forma della molecola. Quindi la geometria delle molecole dipende dal numero di atomi, dalla lunghezza di legame che unisce gli atomi e in particolare dall’angolo che i legami chimici formano tra loro.
L’angolo di legame , si misura in gradi, ed è l’angolo formato dagli assi di due legami chimici che partono dallo stesso atomo.
Per stabilire l’angolo di legame è importante conoscere i tipi di orbitali coinvolti nel legame.
Per determinare tali angoli esiste una teoria, chiamata teoria di VESPR (Valence Shell Electron-Pair Repulsion) o anche teoria della repulsione delle coppie di elettroni del guscio di valenza perchè le coppie di elettroni esterni si respingono reciprocamente.
Secondo questa teoria, quindi l’angolo di legame dipende dal numero di coppie elettroniche , sia quelle impegnate nel legame(simbolo ) , sia quelle libere (simbolo
) che circondano l’atomo centrale (simbolo A).
Le coppie elettroniche che circondano l’atomo centrale, essendo dotate di carica negativa, si dispongono in modo da risultare più lontano possibile l’uno dall’altro.
Quindi considerando i simboli scritti sopra la molecola generale potrebbe essere la seguente: dove A è l’atomo centrale, X gli atomi legati con il legame covalente ed E coppie di elettroni liberi dell’atomo centrale.
In base al numero di coppie elettroniche condivise, intorno al nucleo centrale si hanno:
- molecole o ioni con due coppie elettroniche di legame producono una geometria lineare, con angoli di legame di 180°. La molecola è del tipo
come HCN e
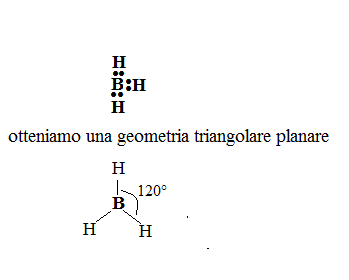
- molecole o ioni con tre coppie elettroniche determinano una geometria triangolare planare, con angoli di legame di 120°. Le molecole possono essere del tipo
come
.
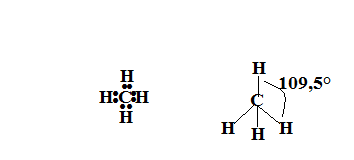
- molecole o ioni con quattro coppie elettroniche determinano un assetto tetraedrico della molecola con angoli di legame di 109,5°. E’ del tipo
come
e
. In una molecola del tipo
come
e
 , gli angoli di legame sono di 107°, la geometria è piramidale triangolare. Infine in una molecola o ione del tipo
, gli angoli di legame sono di 107°, la geometria è piramidale triangolare. Infine in una molecola o ione del tipo come
o
 , l’angolo di legame è di 104,5°, la geometria è angolare.
, l’angolo di legame è di 104,5°, la geometria è angolare.
Molecole con la stessa formula di struttura e la stessa disposizione degli atomi si dicono isosterici.
Consideriamo un po’ di esempi. Per primo consideriamo la molecola di , la cui struttura di Lewis è
Se invece consideriamo la molecola , vediamo che il boro è l’atomo centrale ed è circondato da tre coppie di elettroni, tutte di legame. Per sistemarle il più lontano possibile bisogna formare un triangolo
Nel caso di quattro coppie elettroniche disposte intorno all’atomo centrale si ha una struttura tetraedrica. Per esempio .
Quelle fino ad ora considerate sono molecole in cui l’atomo centrale è circondato da doppietti elettronici di legame.
Quando invece vi sono coppie di elettroni non condivise , oltre alle coppie di elettroni di legame.La repulsione tra coppie di elettroni libere è maggiore della repulsione tra una coppia di elettroni liberi e una condivisa.
Se consideriamo una molecola di ammoniaca, questa avrà una coppia di elettroni libera e le coppie di elettroni condivise sono tre e quindi avremo la forma di un tetraedro, ma la presenza della coppia di elettroni libera porterà ad una maggiore repulsione e quindi l’angolo sarà di 107,3°.
Se vi fossero due coppie di elettroni libere e due condivise la repulsione sarà ancora maggiore e l’angolo sarà di 104,5°.