Osmosi e pressione osmotica
L’osmosi è un processo diffusione che interessa in particolar modo le cellule vegetali e animali. Tale fenomeno si verifica quando una membrana è capace di farsi attraversare solo da certi materiali, quindi è una ,membrana semipermeabile. Passerà del solvente dalla parte con meno particelle alla parte con più particelle. Tali processi osmotici avvengono anche quando la membrana separa due soluzioni, quindi il solvente passerà dalla soluzione meno concentrata a quella più concentrata.
L’osmosi quindi è un processo di diffusione molto importante perchè consente il trasporto dei fluidi vitali nel nostro organismo e il trasferimento della linfa delle piante dalle radici fino alle foglie.
Quindi il processo osmotico non fa altro che bilanciare la concentrazioni di due soluzioni separate da una membrana semipermeabile.
Possiamo definire l’osmosi come il flusso spontaneo delle molecole di solvente da un solvente puro a una soluzione, oppure da una soluzione più diluita a una più concentrata.
L’osmosi avverrà secondo una direzione precisa che dipenderà solo dal diverso numero di particelle di soluto e non dalla natura chimica di esso.
Il processo osmotico avrà termine quando non si raggiunga un equilibrio dinamico, quindi il numero di particelle presenti tra le soluzioni separate dalla membrana non siano le stesse.
Posiamo vedere che se prendiamo un tubo a forma di U, dove al centro poniamo una membrana semipermeabile. In un ramo del tubo ci mettiamo acqua e nell’altro acqua e sale; notiamo che l’acqua comincerà a passare verso la soluzione acqua e sale riducendo la sua altezza e facendo aumentare quella della soluzione. La parte della colonnina che è aumentata, ad un certo punto eserciterà una pressione che si opporrò all’ingresso di altro solvente.
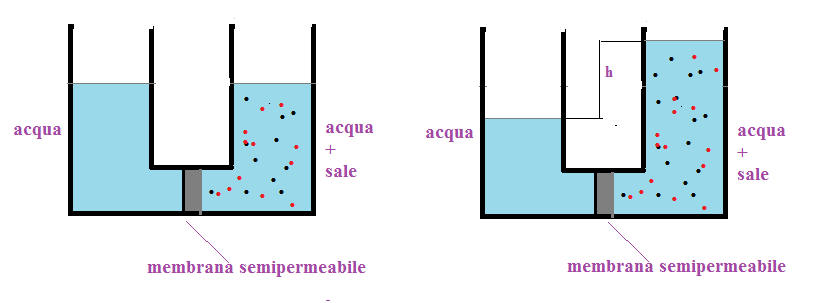
Tale pressione che blocca la diffusione per osmosi , viene chiamata pressione osmotica ed è indicata con la lettera greca pgreco π.
Quindi a questo punto possiamo definire la pressione osmotica (π) come la pressione che bisogna esercitare sulla soluzione più concentrata per impedire il flusso di solvente attraverso la membrana semipermeabile che la separa dal solvente puro (o dalla soluzione più diluita), quindi per raggiungere l’equilibrio osmotico.
Se si applica alla soluzione più concentrata una pressione maggiore di quella osmotica , si ottiene come risultato il passaggio di solvente dalla soluzione più concentrata a quella meno concentrata. Tale processo è chiamato osmosi inversa.
Se due soluzioni contengono un egual numero di particelle di soluto, generano la stessa pressione osmotica e si dicono isotoniche; se ne contengono un numero diverso, quella che ne contiene meno si dice ipotonica e quella che ne contiene di più si dice ipertonica.
Tra la pressione osmotica di una soluzione e la concentrazione di un soluto vi esiste una relazione matematica, che nel caso delle soluzioni diluite è analoga a quella dei gas ideali. Tale equazione è detta equazione di van’t Hoff.
π•V = n•R•T
π= pressione osmotica(atm) V = volume soluzione(L) n= numero di moli del soluto
T= temperatura assoluta (K)
ma n\V sappiamo che è uguale alla concentrazione, cioè la molarità M, quindi:
π=M •R•T
La pressione osmotica è quindi una proprietà colligativa prchè dipende dalla concentrazione della soluzione e dalla temperatura e non dalla natura chimica.
Se il composto in considerazione si dissocia completamente in ioni si deve tener conto del numero di ioni (i), quindi la relazione di sopra diventerà
π•V = n•R•T•i
π=M •R•T •i