Prima di parlare del legame covalente polare ricordiamo il concetto di elettronegatività. Essa è la grandezza che esprime la forza in cui un atomo attira a sè gli elettroni di legame., quindi è semplicemente la capacità di un atomo ad attrarre elettroni.
Essa nella tavola periodica aumenta lungo il periodo e diminuisce scendendo lungo un gruppo.
Il fluoro è l’elemento più elettronegativo.
Il valore dell’elettronegatività è riportato sulla tavola periodica
Se gli atomi sono identici e fra di essi si forma un legame covalente, essi eserciteranno sugli elettroni di legame la stessa forza di attrazione; in questo caso stiamo parlando di legame covalente puro.
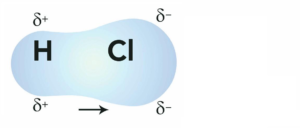
Se gli atomi sono diversi, essi eserciteranno sugli elettroni di legame una diversa forza di attrazione come per l’acido cloridrico HCl e per l’acqua.
Nel primo caso la coppia di elettroni risulta spostata verso l’atomo di cloro perchè è l’atomo più elettronegativo, mentre per l’acqua la coppia di elettroni è spostata verso l’atomo di ossigeno.. In entrambe i casi , il cloro per il primo e l’ossigeno per il secondo sono più elettronegativi dell’idrogeno.
In un legame covalente, l’atomo più elettronegativo contiene una parziale carica negativa mentre l’altro positiva. Per indicare la polarità positiva si usa delta , per quella negativa delta –
.
Quindi alla fine il centro delle cariche positive non coincide con quello delle cariche negative perchè non c’è una distribuzione simmetrica degli elettroni. Maggiore è la differenza di elettronegatività tra due atomi e più grande è la polarità del legame che li unisce.