La legge di Charles
Cento anni dopo gli esperimenti di Boyle ,il fisico francese Jacques Charles individuò la relazione tra volume e temperatura di un gas a pressione costante.(isobara)
Egli affermò che il volume di una determinata quantità di gas, a pressione costante, è direttamente proporzionale alla sua temperatura assoluta. V\T = k
Egli notò come raddoppiando la temperatura assoluta di un gas ideale , il volume raddoppiava, in questo modo l’aumento della forza degli urti è compensata dalla diminuzione della loro frequenza.
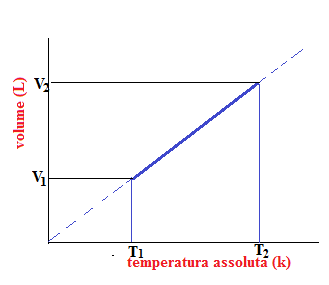
Se su un sistema di assi ortogonali riportiamo il volume sull’ordinata e la temperatura sull’ascissa, notiamo che si otterrà una retta che rappresenterà tale legge.
Consideriamo la situazione in cui per un gas abbiamo due diversi valori di temperatura e volume quindi:
e
Poichè la costante è la stessa possiamo eguagliarli e ottenere:
Da questa relazione è sempre possibile ricavare ogni grandezza se si conoscono tutte le altre tre.
;
;
;
Charles inoltre estrapolò i suoi dati per vedere quale temperatura avrebbe potuto produrre un volume di 0 litri. Trovò una temperatura pari a – 273,15°C. Questa temperatura corrisponde a 0 K sulla scala di temperatura kelvin. La temperatura di 0 k è chiamata zero assoluto.
Quando un gas raggiunge una temperatura prossima allo zero assoluto, diventa un liquido, un solido o, in alcuni casi un condensato.
Nella legge di Charles la temperatura deve sempre essere espressa in kelvin.
Vedi programma di chimica